La télomérase, l’enzyme qui reconstitue les télomères
Peu de temps après avoir analysé la radio faisant apparaître l’ADN des télomères, j’ai été embauchée par l’université de Californie, à Berkeley, où, en 1978, j’ai monté mon propre laboratoire pour poursuivre mes recherches sur ce thème. C’est là que j’ai commencé à remarquer quelque chose qui m’a fait un choc. Je continuais à élever des
Tetrahymena, cette écume d’étang velue qui ressemblait à un Muppet, et je savais maintenant mesurer leurs télomères à partir de la longueur de leur ADN. Et mystérieusement, dans certaines conditions, il arrivait à ces télomères de
s’allonger.
Cela a été un choc car, en cas d’évolution, je m’attendais à les voir éventuellement raccourcir, pas allonger : à chaque division cellulaire, le nombre de leurs séquences d’ADN devait plutôt diminuer. Et pourtant, c’était comme si la
Tetrahymena était en train de créer de l’ADN. Mais cela n’était pas censé se produire. L’ADN n’est pas censé évoluer. Vous avez sans doute entendu dire que l’ADN avec lequel nous naissons est celui avec lequel nous mourrons et qu’il n’est reproduit que par une sorte de photocopie biochimique. J’ai vérifié, revérifié et confirmé que l’impossible en théorie se produisait bien dans la réalité. Nous avons ensuite observé aussi le même phénomène dans les cellules de levure. (« Nous » inclut ici mon étudiante Janice Shampay qui travaillait dans mon labo sur les expériences dont Jack Szostak, chercheur à Harvard et moi avions rêvé ensemble.) Puis des comptes rendus de confrères nous sont parvenus indiquant que de tels changements s’observaient également chez d’autres minuscules créatures proches des
Tetrahymena. Ces organismes fabriquaient bien de l’ADN à l’extrémité de leurs télomères. Ceux-ci s’allongaient.
Aucune autre partie de l’ADN ne se comporte ainsi. Pendant des dizaines d’années, les généticiens ont cru que toute portion d’ADN chromosomique n’existait que parce qu’elle avait été copiée à partir d’un ADN préexistant. Il était admis que l’ADN ne pouvait être créé de toutes pièces, à un endroit où il n’y en avait pas déjà. La découverte de cet étrange comportement m’a indiqué
qu’il se passait là quelque chose que personne n’avait jamais vu avant. Pour un chercheur, c’est le type de découverte le plus excitant qu’il soit. C’est passionnant de trouver quelque chose d’étrange qui suggère l’existence dans l’univers de nouveaux recoins inexplorés, prêts pour l’investigation. Finalement, ce comportement des télomères a débouché sur autre chose que la simple mise au jour d’un nouveau recoin de l’univers : il a révélé une contrée tout entière, dont personne ne connaissait encore l’existence.
La télomérase : la solution au rétrécissement télomérique
J’ai continué à m’interroger sur ce comportement étrange des télomères, leur apparente capacité à s’allonger. J’ai voulu rechercher une enzyme cellulaire susceptible de leur ajouter de l’ADN : une enzyme capable de reconstituer les paires de lettres qu’ils avaient perdues. Il était temps pour moi de me retrousser les manches et de produire davantage d’extraits cellulaires de
Tetrahymena. Pourquoi elle ? Comme c’était une source si abondante de télomères, je me suis dit qu’elle pourrait aussi en être une pour l’enzyme qui les fabriquait, si jamais elle existait.
En 1983, Carol Greider, une nouvelle étudiante de mon labo, m’a rejointe dans cette quête. Nous avons commencé à élaborer des expériences, puis à en améliorer le protocole, et le jour de Noël 1984, Carol a développé une image appelée « autoradiographie ». Ce qu’on y voyait étaient les premiers signes indéniables de l’activité d’une nouvelle enzyme. Carol est rentrée chez elle et elle a dansé de joie dans son salon.
Le lendemain, le visage rayonnant d’une jubilation contenue dans l’anticipation de ma réaction, elle m’a montré la radio. On s’est regardées. Chacune de nous savait que c’était ça. Les télomères pouvaient reconstituer leur ADN en attirant cette enzyme inconnue jusque-là, que notre labo a appelée « télomérase ». Celle-ci crée de nouveaux télomères à l’image de sa propre séquence biochimique.
Mais les progrès de la science ne se fondent pas sur un unique eurêka, aussi génial soit-il. Nous devions être certaines. Semaine après semaine, mois après mois, les frissons de joie ont succédé aux vagues de doute tandis que nous répétions laborieusement les expériences. Étape par étape, nous avons éliminé tout ce qui aurait pu faire de notre extraordinaire découverte de 1984 une simple fausse piste. Nous avons fini par mieux comprendre la télomérase : c’est bien elle l’enzyme qui restaure l’ADN perdu lors de la division cellulaire. C’est elle qui fabrique et qui reconstitue les télomères.
Voici comment elle fonctionne. Elle est constituée de protéines et d’ARN, que vous pouvez concevoir comme une copie de l’ADN. Cette copie contient un modèle de la séquence ADN du télomère. La télomérase utilise cette séquence d’ARN comme guide biochimique personnel pour créer la bonne séquence d’ADN tout neuf. Une séquence correcte est indispensable à la mise en place d’une structure parfaite pour attirer un gainage de protéines protectrices des télomères autour de leur ADN. Guidée par la séquence modèle d’ARN et par le système de couplage des lettres de l’ADN, la télomérase ajoute ce nouveau fragment d’ADN à l’extrémité du chromosome. Ce système permet d’être sûr que les éléments d’ADN télomérique ajoutés sont bien les bons. Et c’est ainsi que la télomérase recrée de nouvelles unités à l’extrémité des chromosomes et qu’elle remplace celles qui ont été usées.
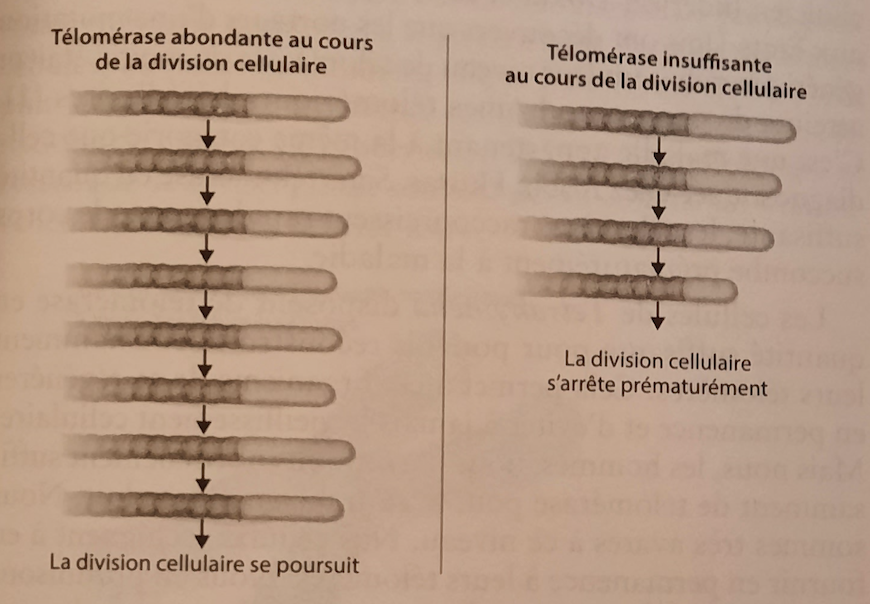
Le mystère des télomères qui s’allongent était résolu. La télomérase les restaure en leur ajoutant de l’ADN télomérique. À chaque division cellulaire, les télomères raccourcissent progressivement jusqu’à atteindre une taille critique qui conduit à un arrêt du processus. Mais la télomérase contrecarre ce phénomène en ajoutant de l’ADN et en reconstruisant l’extrémité du chromosome à chaque division. Le chromosome est alors protégé et exactement recopié dans la nouvelle cellule. Celle-ci peut continuer à se reproduire. La télomérase peut ralentir, empêcher, voire inverser, le raccourcissement télomérique lié à la division cellulaire. Les télomères sont, en un sens, rajeunis par la télomérase. Nous avions découvert un moyen de contourner la limite de Hayflick imposée aux cellules… dans de l’écume d’étang.
La télomérase n’est pas un élixir d’immortalité
À la suite de cette découverte, le monde scientifique et celui des médias se sont mis à bruisser de spéculations pleines d’espoir. Et s’il était possible d’accroître notre stock de télomérase ? Pourrait-on être comme la
Tetrahymena avec des cellules se renouvelant à l’infini ? (Cela doit être la première fois de l’histoire que des hommes ont ardemment souhaité ressembler à de l’écume d’étang.)
Les gens se sont demandé si la télomérase pouvait être distillée et servie comme élixir d’immortalité. Dans ce scénario fantaisiste, on se rendrait de temps à autre à son bar à télomérase habituel pour une dose d’enzyme, ce qui nous permettrait de vivre en bonne santé jusqu’au bout de notre durée de vie maximale connue – voire au-delà.
Ces rêves ne sont peut-être pas aussi ridicules qu’ils le paraissent. Les télomères et la télomérase sont un fondement biologique essentiel du vieillissement cellulaire. C’est encore la
Tetrahymena qui a permis d’apporter la démonstration du lien entre télomérase et vieillissement cellulaire. Guo-Liang Yu, alors étudiant dans mon laboratoire de Berkeley, a réalisé une expérience simple, mais d’une précision chirurgicale. Il a remplacé la télomérase normale de cellules de
Tetrahymena par une version inactivée. Si on les nourrit correctement, les cellules de
Tetrahymena sont normalement immortelles en laboratoire. Comme le lapin de la pub pour les piles, leur division ne s’arrête jamais. Mais cette télomérase inactivée a entraîné un raccourcissement télomérique au fil des divisions. Une fois devenues trop courtes pour protéger les gènes des chromosomes, les cellules ont arrêté de se multiplier. Repensez au lacet. C’est comme si son extrémité s’était usée et qu’il s’était effiloché – avec tout son matériel génétique vital. L’inactivation de la télomérase rendait les cellules de
Tetrahymena mortelles.
Sans télomérase, les cellules cessent de se renouveler.
Par la suite, dans d’autres laboratoires dans le monde, le même phénomène a été découvert dans presque toutes les cellules, sauf les bactéries (dont les chromosomes contiennent de l’ADN circulaire et non linéaire, et qui n’ont donc pas d’extrémités à protéger). Des télomères longs et de la télomérase en quantité retardaient le vieillissement cellulaire prématuré tandis que des télomères courts et moins de télomérase l’accéléraient. Le lien télomérase-santé a été validé quand le clinicien Inderjeet Dokal et ses collègues au Royaume-Uni et aux États-Unis ont découvert que les porteurs d’une mutation génétique réduisant leur niveau de télomérase de moitié étaient atteints de graves syndromes télomériques héréditaires. C’est une maladie appartenant à la même catégorie que celle diagnostiquée chez Robin Huiras. Sans télomérase en quantité suffisante, les télomères raccourcissent rapidement et le corps succombe prématurément à la maladie.
Les cellules de
Tetrahymena disposent de télomérase en quantité suffisante pour pouvoir reconstruire constamment leurs télomères. Cela permet à cet organisme de se régénérer en permanence et d’éviter à jamais le vieillissement cellulaire. Mais nous, les hommes, nous n’avons pas normalement suffisamment de télomérase pour accomplir un tel exploit. Nous sommes très avares à ce niveau. Nos cellules rechignent à en fournir en permanence à leurs télomères. Nous en produisons en quantité suffisante pour les reconstruire… mais seulement jusqu’à un certain point. En vieillissant, la télomérase de la plupart de nos cellules devient généralement moins active et nos télomères raccourcissent.
La télomérase et le paradoxe du cancer
Il est naturel de se demander si on peut accroître notre durée de vie en augmentant artificiellement notre taux de télomérase. Les publicités pour des activateurs de télomérase sont légion sur Internet affirmant que c’est possible. La télomérase et les télomères ont des propriétés merveilleuses qui peuvent nous permettre d’éviter des pathologies horribles et de nous sentir plus jeunes. Mais ce ne sont pas des prolongateurs de vie magiques – ils ne nous permettront pas de dépasser l’espérance de vie normale telle que nous la connaissons. En réalité, si vous tentez de prolonger votre existence en accroissant artificiellement votre taux de télomérase, vous vous mettez en danger.
Cela tient au côté sombre de la télomérase. Rappelez-vous du Dr Jekyll et de M. Hyde – c’est la même personne, mais avec un caractère complètement différent le jour et la nuit. Nous avons besoin de notre bonne télomérase Dr Jekyll pour rester en bonne santé, mais, si on en a trop, dans les mauvaises cellules, au mauvais moment, elle se transforme en M. Hyde pour alimenter une croissance cellulaire incontrôlée, caractéristique du cancer. Le cancer est, à la base, des cellules qui ne cessent de se diviser ; il est souvent défini comme un « renouvellement cellulaire devenu fou ».
Vous ne voulez pas bombarder vos cellules avec de la télomérase artificielle qui peut les inciter à emprunter la voie menant au cancer. Tant que le domaine des compléments à base de télomérase n’a pas apporté de démonstration convaincante de leur innocuité dans des essais cliniques sur de vastes populations – et
à long terme –, il nous semble raisonnable de se passer de pilules, crèmes ou piqûres prétendant accroître le taux de cette enzyme. Selon votre risque individuel de développer un certain type de cancer, vous pouvez potentiellement vous retrouver à augmenter votre probabilité de tomber malade (d’un mélanome, d’un cancer du cerveau ou des poumons). Sachant cela, il n’est pas étonnant que nos cellules gardent un contrôle strict de leur télomérase.
Compte tenu de ces caractéristiques plutôt effrayantes, vous pouvez vous demander pourquoi nous vous suggérons dans ce livre des activités qui stimulent la télomérase ? La réponse, c’est qu’il y a une grosse différence entre les réactions physiologiques normales aux changements de style de vie que nous proposons ici pour votre santé et la prise de produits artificiels (peu importe l’origine « naturelle » des plantes dont ils sont extraits – souvenez-vous que les plantes sont parmi les guerriers chimiques les plus importants de la nature, ayant développé avec l’évolution une panoplie de puissants toxiques pour se protéger des animaux affamés et des pathogènes qui rôdent). Ce que nous proposons dans ce livre pour accroître l’activité de votre télomérase, ce sont des stratégies douces et naturelles – et qui l’élèvent à un niveau sans danger. Avec elles, vous n’avez pas à vous inquiéter d’un accroissement de votre risque de cancer. Elles n’augmentent tout simplement pas votre télomérase dans des proportions ou d’une manière qui serait toxique.
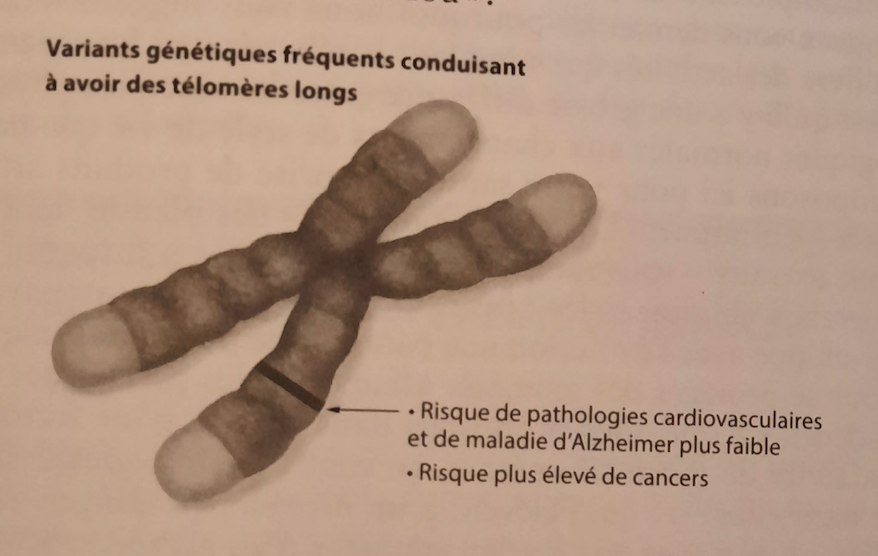
Paradoxalement, nous avons réellement besoin de préserver la santé de nos télomères pour nous protéger aussi du cancer. Certains types de cancer ont tendance à se développer quand
une insuffisance de télomérase rend les télomères trop courts : des cancers du sang comme la leucémie, de la peau, hormis le mélanome et certains cancers gastro-intestinaux, comme celui du pancréas. La démonstration en a été faite par la découverte que les porteurs d’une mutation héréditaire inactivant spécifiquement un gène de la télomérase ont un risque bien plus élevé de développer ces cancers. Ceux-ci surviennent en raison de la perte de protection assurée par les télomères, qui rend les gènes vulnérables – et des gènes défectueux peuvent conduire au cancer. Par ailleurs, un déficit en télomérase affaiblit les télomères de nos cellules immunitaires. Notre système immunitaire est habituellement à l’affût de tout ce qui lui semble « étranger », qu’il s’agisse de cellules cancéreuses nocives ou de pathogènes venant envahir l’organisme, comme les virus ou les bactéries. Quand leurs télomères ne sont plus assez longs pour les protéger, ces cellules finissent par entrer en sénescence.
Certaines de ces cellules immunitaires sont comme des caméras de surveillance postées dans tous les coins de notre corps. Quand elles deviennent sénescentes, c’est comme si leur objectif était embué, ce qui les empêche de repérer les cellules cancéreuses « étrangères ». Les équipes d’intervention ne passent alors pas à l’action. Les défenses immunitaires de l’organisme ont donc plus de chances de perdre leur combat contre un cancer (ou un pathogène), du fait de cet affaiblissement des télomères.
La télomérase : un espoir pour de nouveaux traitements anticancer
Trop de télomérase, stimulée par l’activation de variants même normaux de ses gènes, accroît les risques de développer plusieurs types de cancer. Un tel excès vient encore alimenter la plupart des tumeurs devenues malignes. Mais même ce « côté sombre » de la télomérase ne sera pas forcément toujours sombre. Les chercheurs ont découvert son hyperactivité dans 80 % à 90 % des cancers malins chez l’homme, avec des taux de dix à cent fois plus élevés que dans les cellules normales. Cela pourra un jour devenir une arme puissante dans notre combat contre la maladie. Si la télomérase est indispensable à la croissance incessante des tumeurs, sans doute pourrons-nous trouver un traitement privant de télomérase les seules cellules malignes. Les chercheurs travaillent en ce sens.
La clé consiste à réguler correctement l’action de la télomérase sur les télomères – dans les bonnes cellules et au bon moment, car c’est seulement cela qui nous maintiendra nous et nos télomères en bonne santé. Notre corps sait comment y arriver, et nous pouvons l’aider en menant un style de vie riche en stratégies de renouveau.
Vous pouvez agir sur vos télomères et votre télomérase
En ce nouveau millénaire, les scientifiques ont pris l’habitude de considérer les télomères et la télomérase comme fondements du renouvellement cellulaire. Mais les syndromes télomériques, avec pour commencer la découverte bouleversante que la seule baisse de moitié du niveau de télomérase peut avoir un effet tout à fait radical, ont incité tout le monde à réfléchir uniquement en termes de
gènes venant déterminer la longueur de nos télomères et la quantité de télomérase suffisante ou non pour les restaurer quand ils sont usés.
C’est à ce moment-là que j’ai (Elissa) obtenu une allocation postdoctorale en psychologie de la santé à l’université de Californie, à San Francisco. Suzanne Folkman, directrice actuellement à la retraite au Centre Osher de Médecine Intégrative et pionnière dans la recherche sur le stress et le
coping, m’a invitée à rejoindre une équipe qui faisait passer des entretiens à des mères d’enfants souffrant de maladies chroniques, groupe vivant un stress psychologique considérable.
J’ai ressenti une profonde empathie pour ces mères soignantes qui avaient l’air extraordinairement usé et plus vieux que leur âge chronologique. À l’époque, Liz avait rejoint le campus de l’université de Californie à San Francisco, et j’avais connaissance de ses travaux sur le vieillissement biologique. Je l’ai contactée et je lui ai parlé des mères que nous étudiions. Si on parvenait à réunir les fonds, serait-il possible de mesurer leurs télomères et leur télomérase ? Cela valait-il la peine de rechercher si le stress pouvait raccourcir les télomères et entraîner un vieillissement cellulaire prématuré ?
L’effet Télomère : une approche révolutionnaire pour allonger sa vie et ralentir les effets du vieillissement, Dʳ Elizabeth Blackburn et Dʳ Elissa Epel, éd. Guy Trédaniel, 2017, p. 73 à 82.